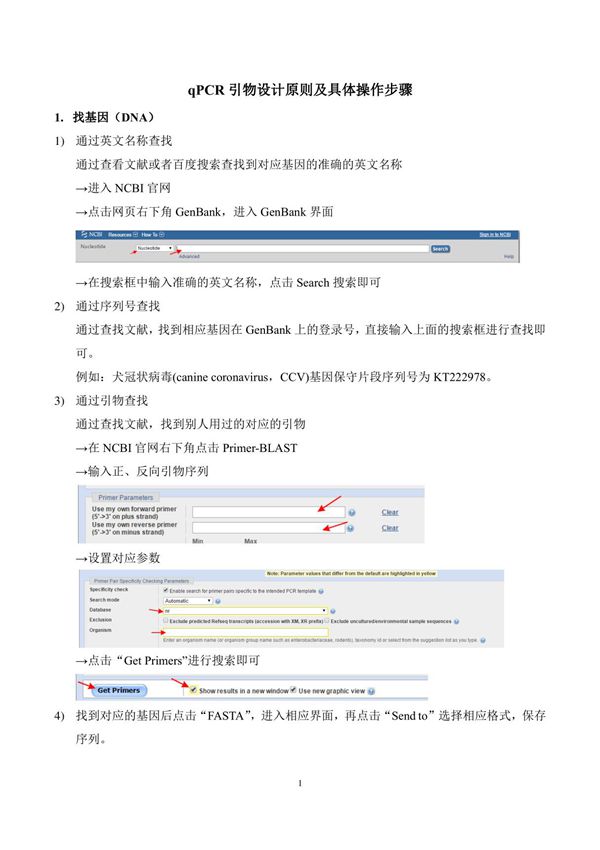
qPCR引物设计原则及具体操作步骤简介qPCR(实时定量PCR)是一种广泛应用于基因表达分析、病原体检测和基因分型的技术。引物设计是qPCR实验成功的关键因素之一,合理的引物设计可以提高扩增效率和特异性。以下是qPCR引物设计的主要原则及操作步骤:**设计原则**1.**长度**:引物长度通常为18-22个碱基,过短可能降低特异性,过长可能增加非特异性结合。2.**Tm值**:引物的熔解温度(Tm)应在55-65℃之间,上下游引物的Tm值差异不超过2℃。3.**GC含量**:GC含量建议在40%-60%之间,避免过高或过低影响引物稳定性。4.**避免二级结构**:引物自身或引物间不应形成发夹结构或二聚体,否则会干扰扩增。5.**3'端特异性**:引物的3'端最后1-2个碱基应为G或C,以提高结合效率,但避免连续3个G或C。6.**避免重复序列**:引物中不应包含长串单一碱基(如AAAAA或CCCCC),以免影响结合特异性。7.**跨内含子设计**(针对cDNA):若检测mRNA,引物应跨外显子-外显子连接区,避免基因组DNA污染。**操作步骤**1.**获取目标序列**:从NCBI或其它数据库获取目标基因的DNA或cDNA序列。2.**选择引物区域**:优先选择保守区域,避免SNP或突变位点。3.**使用设计软件**:利用Primer-BLAST、OligoCalc或Primer3等在线工具生成候选引物。4.**评估引物质量**:检查Tm值、GC含量、二级结构及特异性(通过BLAST比对)。5.**合成与验证**:合成引物后,通过qPCR实验验证扩增效率和特异性(如熔解曲线分析)。遵循以上原则和步骤,可设计出高效、特异的qPCR引物,确保实验结果的准确性和可重复性。