在有机物中,碳原子通过sp³、sp²和sp三种杂化方式形成不同的空间构型。sp³杂化的碳原子形成四面体结构,键角约为109.5°,常见于烷烃;sp²杂化的碳原子形成平面三角形结构,键角约为120°,存在于烯烃和芳香烃中;sp杂化的碳原子呈直线型,键角为180°,如炔烃中的碳碳三键。这些杂化方式决定了有机分子的立体构型和化学性质。
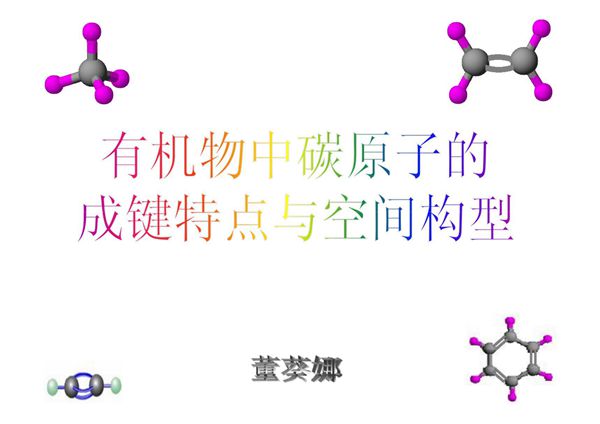
在有机物中,碳原子通过sp³、sp²和sp三种杂化方式形成不同的空间构型。sp³杂化的碳原子形成四面体结构,键角约为109.5°,常见于烷烃;sp²杂化的碳原子形成平面三角形结构,键角约为120°,存在于烯烃和芳香烃中;sp杂化的碳原子呈直线型,键角为180°,如炔烃中的碳碳三键。这些杂化方式决定了有机分子的立体构型和化学性质。

声明:资源收集自网络无法详细核验或存在错误,仅为个人学习参考使用,如侵犯您的权益,请联系我们处理。
不能下载?报告错误